Mechanika kwantowa/Teoria atomu wodoru Bohra
Licencja
|
|---|
|
Autor: Mirosław Makowiecki
Absolwent UMCS Fizyki Komputerowej Uniwersytetu Marii Curie-Skłodowskiej w Lublinie Email: miroslaw(kropka)makowiecki(małpa)gmail(kropka)pl Dotyczy: książki, do której należy ta strona, oraz w niej zawartych stron i w nich podstron, a także w nich kolumn, wraz z zawartościami. Użytkownika książki, do której należy ta strona, oraz w niej zawartych stron i w nich podstron, a także w nich kolumn, wraz z zawartościami nie zwalnia z odpowiedzialności prawnoautorskiej nieprzeczytanie warunków licencjonowania. Umowa prawna: Creative Commons: uznanie autorstwa, na tych samych warunkach, z możliwością obowiązywania dodatkowych ograniczeń. Autor tej książki dołożył wszelką staranność, aby informacje zawarte w książce były poprawne i najwyższej jakości, jednakże nie udzielana jest żadna gwarancja, czy też rękojma. Autor nie jest odpowiedzialny za wykorzystanie informacji zawarte w książce, nawet jeśli wywołaby jakąś szkodę, straty w zyskach, zastoju w prowadzeniu firmy, przedsiębiorstwa lub spółki bądź utraty informacji, niezależnie czy autor (a nawet Wikibooks) został powiadomiony o możliwości wystąpienie szkód. Informacje zawarte w książce mogą być wykorzystane tylko na własną odpowiedzialność. |
Podręcznik: Mechanika kwantowa.
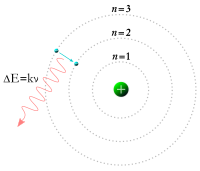
Będziemy się tu zajmować atomem wodoru według postulatów podanych Bohra.
Teoria nierelatywistyczna Bohra atomów wodoropodobnych
edytujBędziemy tutaj rozważali teorię Bohra atomu wodoropodobnego według mechaniki Newtona.
Postulaty teorii Bohra dla atomów wodoropodobnych
edytujZałóżmy, że elektrony krążą po orbitach kołowych opisywanych przez mechanikę klasyczną, a poszczególne orbity są skwantowane . Elektron może przechodzić z jednej orbity na drugą wysyłając lub wchłaniając kwant energii.
- A oto postulaty Bohra:
Postulat pierwszy :
Elektron przeskakujący z jednej orbity na drugą wydziela lub musi pochłonąć foton o energii:

Według (2.1) foton ma częstość ν, jeśli potraktować foton jako fale, jest to kwant energii, jeśli potraktować foton jako korpuskułę według teorii korpuskularno-falowej, a każdej orbicie odpowiada pewna energia całkowita znajdującego się tam elektronu.
Postulat drugi :
Elektron porusza się po orbicie kołowej z pewną prędkością opisywaną przez mechanikę klasyczną Newtona.
Postulat trzeci :
Moment pędu elektronu na orbicie jest skwantowany i proporcjonalny do liczby kwantowej n i wynosi:

Widzimy, że wedle wzoru pierwszego w (2.2) moment pędu przyjmuje pewne wartości ściśle określone i zależne od liczby kwantowej n. A wedle drugiego wzoru, jeśli mamy orbitę kołową i mamy pewne r, co jest promieniem orbity kołowej, to również też mamy pewne v, czyli prędkość cząstki krążącej na tej orbicie, zatem dochodzimy do wniosku, że promień orbity i prędkość cząstki są wielkościami dyskretnymi, a zatem też jej energia jest wielkością przyjmującą pewne wartości zależne tylko od liczby dyskretnej n.
Wyprowadzenie wzoru Rydberga
edytujSiła dośrodkowa działająca na elektron ze strony jądra atomu wodoru zależy od prędkości elektronu, który się porusza wokół jądra, po orbicie kołowej, wartość tej siły jest wszędzie jednakowa na orbicie kołowej, a jej kierunek przechodzi przez środek jądra atomowego, który w tym przypadku przyjmujemy za punktowe, a zwrot jest skierowany w kierunku jądra atomowego:

Siła Coulomba znana z elektrostatyki, jeśli założymy, że w jądrze skupiony jest ładunek Ze, który oddziaływuje z elektronem na orbicie o ładunku -e, jest przyciągająca w kierunku jądra atomowego, która jest jednocześnie siłą dośrodkową (2.3) i ma wartość zapisaną jako funkcję promienia orbity kołowej r.

Porównując te dwie siły, tzn. siłę elektrostatyczną działająca ze strony nieporuszającego się ciężkiego jądra wedle wzoru (2.4), która jest niezrównoważoną siłą, ze wzorem wynikającego z mechaniki klasycznej Newtona (2.3) i łącząc te dwie siły, bo mają ten sam zwrot, kierunek i wartość.

Mnożymy obustronnie równanie (2.5) przez promień orbity kołowej elektronu r, to otrzymujemy inną równoważną zależność, w której występuje na razie prędkość cząstki i promień tejże rozważanej orbity:

Korzystamy ze wzoru (2.2) na skwantowany moment pędu i wyznaczamy z niego odwrotność promienia orbity kołowej, po której porusza się elektron:

Podstawiamy wyrażenie (2.7) na odwrotność promienia orbity do wzoru (2.6), to dostajemy wzór, który przedstawia prędkość cząstki w zależności od liczby kwantowej w jakieś uwikłanej postaci:

Teraz skracając przez wartość prędkości v z jaką elektron okrąża pewną orbitę kołową w równości (2.8) oraz wiedząc, że prędkość elektronu na orbicie jest wielkością niezerową, bo ona nie może być tam w spoczynku, bo inaczej spadł by na jądro atomowe:

Dzieląc obustronnie wzór (2.9) przez masę elektronu m dostajemy wzór na jawną postać jak zależy prędkość elektronu na pewnej ściśle określonej orbicie kołowej w zależności od dyskretnej (kwantowej) liczby n, która przyjmuje wartości naturalne bez zera.

A teraz policzmy promień n-tej orbity z równania (2.2) na skwantowaną prędkość cząstki na orbicie kołowej po wyznaczeniu z niego promienia tejże orbity:

Podstawiamy wyrażenie (2.10) na kwantową prędkość elektronu krążącego na skwantowanej ściśle określonej orbicie kołowej do wyrażenia (2.11) wynikającego z postulatu trzeciego Bohra, to otrzymamy wyrażenie na dyskretny promień orbity:

Ostatecznie w równaniu (2.12) po krótkich przekształceniach dostajemy wzór na skwantowany promień orbity kołowej zależący od jednej liczby kwantowej n:

Z definicji energii kinetycznej według mechanice klasycznej, którą zapiszemy w zależności od jego wartości prędkości, po podstawieniu za wartość dyskretną prędkości wzoru (2.10), otrzymujemy:

Teraz napiszmy energię potencjalną elektronu na orbicie, po której krąży elektron o promieniu skwantowanym r, z definicji energii potencjalnej dla pola elektrostatycznego, mamy:

Podstawmy we wzorze na energię potencjalną cząstki w polu elektrostatycznym (2.15) za r, będące skwantowanym promienień orbity kołowej, czyli wzoru (2.13), otrzymując:

Wzór na całkowitą energię mechaniczną, która jest sumę energii kinetycznej wedle końcowego wzoru (2.14) i energii potencjalnej (2.16), jest zapisana wedle schematu:

Energia całkowita elektronu krążącego wokół jądra jest ujemna, a więc elektron jest związany z jądrem atomowym, co przypuszczaliśmy, że tak może wyjść. Z pierwszego postulatu Bohra zdefiniowaną w punkcie (2.1) możemy napisać, że długość fali jest napisana w sposób uwikłany w zależności z jakiej do jakiej orbity nasz elektron przeskakuje.

Wzór (2.18) przedstawiający energię całkowitą fotonu, który zostaje wypromieniowany lub pochłonięty przez elektron, co stąd wyznaczamy odwrotność długości fali fotonów:

Podstawiamy za E2 (gdy n=n2) i za E1 (gdy n=n1), czyli wzoru (2.17) na całkowitą energię elektronu krążącej na orbicie kołowej dla tych napisanych n do wyrażenia (2.19), to dostajemy wzór na odwrotność długości fali jaki elektron wyemituje foton o tej właśnie długości:

Stałą Rydberga we wzorze (2.20) nazywamy przepis, która jest zależna od stałych fizycznych i od masy elektronu krążącej wokół jądra atomowego o liczbie atomowej Z, przedstawiany:

Wykorzystując definicję stałej Rydberga (2.21) we wzorze (2.20), to dochodzimy do wniosku, że długość fali emitowanych fotonów z atomu, przy przejściu elektronu z poziomu n2 na poziom n1, jest równa:

W wyrażeniu (2.22) zachodzi n2>n1, ale n2 i n1, gdzie to są główne liczby kwantowe, by to nasze wyrażenie miało długość fali dodatnią, ale nie zerową. Wzór (2.22) przedstawia długość fali wypromieniowanej z elektronu przy przejściu z orbity wyższej na orbitę niższą bardziej korzystną energetycznie.
Serie w atomie wodoru
edytujAtomem wodoru nazywamy atom o liczbie atomowej Z=1, tzn. jego jądro atomowe składa się z jednego protonu, już nie mówiąc o neutronach, czyli poniższe serie można wyznaczyć ze wzoru wynikającego z (2.22) dla wspomnianego Z, czyli:

 .
.
Można wyznaczyć poszczególne serie dla atomu wodoru, które powstają wyniku przejścia z orbity o liczbie kwantowej n2 do orbity o liczbie kwantowej n1, zatem nazwy tych serii są:
- dla
-- seria Lymana,
- dla
-- seria Balmera,
- dla
-- seria Paschena,
- dla
-- seria Bracketta,
- dla
-- seria Pfunda,
- dla
-- seria Humphreysa